NGHIÊN CỨU CÁC LOẠI PIN SỬ DỤNG CHO XE ĐIỆN
Xe điện nói chung và xe ô tô điện nói riêng có lịch sử khá lâu đời, thậm chí chúng còn xuất hiện trước cả xe sử dụng động cơ đốt trong. Xe điện sử dụng pin chì – axít có thể sạc lại được phát triển sớm nhất vào năm 1859 bởi Gastron Platé. Năm 1899, Waldemar Jungner giới thiệu pin Niken – Cadimi với khả năng lưu trữ được nhiều năng lượng hơn nhưng nó lại có một nhược điểm lớn ảnh hưởng đến tuổi đời của pin là “hiệu ứng nhớ”. Những nghiên cứu về pin tiếp tục được tiến hành, và đến năm 1985 thì lần đầu tiên pin Lithium – ion (Li-ion) được tạo ra. Trong khi đó, xe điện sử dụng pin ZEBRA và pin Niken-MH (Metal Hydride) đã được phát triển. Trong bài viết này sẽ giới thiệu một số loại pin sử dụng cho xe điện.
1. Pin (ắc quy) chì axit.
a. Tổng quan về pin chì axit.
Pin chì axit từng được biết đến là loại tốt nhất và phổ biến nhất được sử dụng trên xe điện. Hiện nay, nó vẫn được sử dụng rộng rãi trên xe sử dụng động cơ đốt trong. Tuy nhiên trên xe điện pin cần phải có công suất lớn hơn và chu kỳ sạc xả dài hơn nên pin chì axit không đáp ứng được. Do đó người ta đã sử dụng chất điện phân dạng keo để thay thế cho axit (pin khô). Tuy nhiên điều này làm tăng giá thành của sản phẩm.
Pin chì – axit có các tấm điện cực âm làm bằng kim loại chì (Pb) và các tấm điện cực dương làm bằng chì oxit (PbO2). Hai điện cực này được ngâm trong dung dịch điện phân là axit sunphuric (H2SO4). Khi ắc quy phóng điện, nạp điện sẽ xảy ra các phản ứng hóa học trên các điện cực của pin (trên hình 1).
Pin chì axit là loại pin sạc được sử dụng phổ biến nhất trong bất kỳ hệ thống nào ngoại trừ các hệ thống nhỏ. Lý do chính cho điều này là các thành phần chính cấu thành nên pin (chì, axit sulfuric, hộp nhựa) không đắt, nó hoạt động đáng tin cậy và nó có điện áp tương đối cao khoảng 2 V trên mỗi cell. Các đặc tính tổng thể của pin được trình bày trong bảng 1 dưới đây.
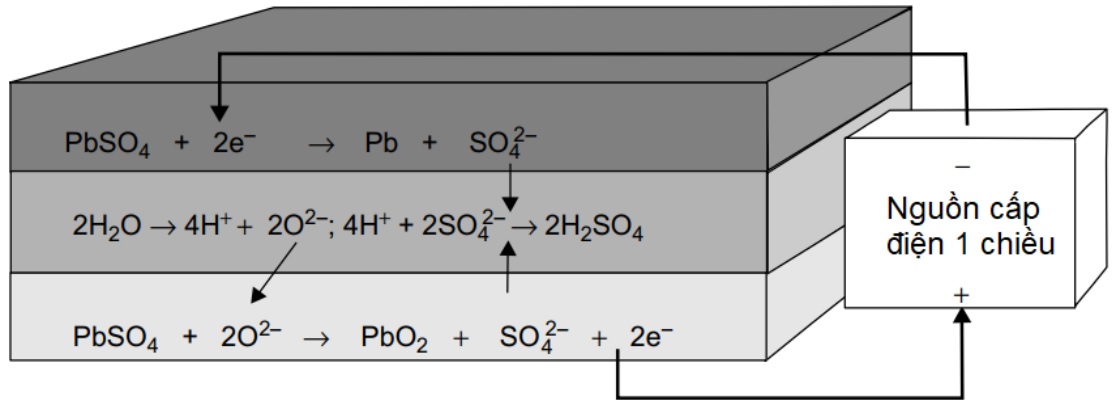
Hình 1. Quá trình xảy ra trong pin chì – axit khi pin được nạp điện
Bảng 1. Thông số của pin chì axit
|
Thông số |
Giá trị |
Ghi chú |
|
Năng lượng riêng |
20 - 35 Wh/kg |
Phụ thuộc vào cách dùng |
|
Mật độ năng lượng |
54 - 95 Wh/L |
|
|
Công suất riêng |
» 250 W/kg |
|
|
Điện áp danh nghĩa của cell |
2 V |
|
|
Hiệu suất dung lượng |
» 80 % |
Phụ thuộc vào nhiệt độ và lượng điện tích trữ |
|
Nội trở |
» 0.022 W |
trên mỗi cell có dung lượng 1Ah |
|
Tính thương mại |
sẵn có |
|
|
Nhiệt độ làm việc |
nhiệt độ môi trường |
Hiệu suất sẽ rất thấp nếu nhiệt độ quá thấp |
|
Tự xả điện |
» 2% trên ngày |
|
|
Chu kỳ sạc xả |
800 lần |
đến khi còn khoảng 80 % dung lượng |
|
Thời gian sạc |
8 giờ |
1 giờ có thể sạc được 90% |
Một trong những đặc điểm đáng chú ý của pin chì axit là nội trở của nó vô cùng thấp. Điều đó có nghĩa là độ sụt áp do dòng tải của nó rất nhỏ và có lẽ là nhỏ nhất trong tất cả các loại pin. Các thông số được đưa ra trong bảng trên là tính cho 1 cell pin có dung lượng danh nghĩa là 1Ah. Dung lượng của mỗi cell tỉ lệ thuận với diện tích của các tấm điện cực, còn nội trở thì lại tỉ lệ nghịch với diện tích các tấm điện cực. Do đó, nội trở sẽ tỉ lệ nghịch với dung lượng. Giá trị nội trở 0,022W trong bảng 1 là được tính trong điều kiện chất lượng của pin còn tốt. Ta có công thức tính nội trở của viên pin chì axit như sau:
R = n.0,022/C10 (W)
Trong đó:
n: số lượng cell trong pin
C10: dung lượng của pin khi phóng điện trong khoảng 10 giờ.
b. Các đặc điểm đặc biệt của pin chì axit.
Bên trong pin chì axit không phải chỉ xảy ra những phản ứng như được nêu như trên hình 1. Chì và chì điôxít không bền trong axit sunfuric, và bị phân hủy, mặc dù rất chậm, với các phản ứng sau:
Tại cực dương: 2PbO2 + 2H2SO4 → 2PbSO4 + 2H2O + O2
Tại cực âm: Pb + H2SO4 → PbSO4 + H2
Điều này dẫn đến việc pin tự xả. Tốc độ xảy ra các phản ứng này phụ thuộc vào nhiệt độ của cell: nhanh hơn nếu nóng hơn. Nó cũng phụ thuộc vào các yếu tố khác, chẳng hạn như độ tinh khiết của các thành phần và các hợp kim được sử dụng để chế tạo các giá đỡ điện cực. Những phản ứng không mong muốn này, cũng tạo ra khí hydro và oxy, cũng xảy ra trong khi pin đang xả. Trên thực tế, chúng xảy ra nhanh hơn nếu pin được xả nhanh hơn, do để điện áp thấp hơn, nhiệt độ cao hơn và hoạt động của điện cực cao hơn. Điều này dẫn đến kết quả là xảy ra hiện tượng chai pin khi pin cạn nhanh hơn. Một thực tế đáng tiếc nữa là những phản ứng phóng điện này sẽ không xảy ra với tỷ lệ như nhau trong tất cả các cell pin, và do đó một số cell sẽ xả điện nhiều hơn những cell khác. Điều này rất quan trọng đối với cách thức pin được sạc. Tuy nhiên, tóm lại, điều đó có nghĩa là một số cell sẽ phải chịu đựng "sạc quá mức" để đảm bảo tất cả các ô đều được sạc. Các phản ứng xảy ra trong pin chì axit khi nó được “sạc quá mức” được thể hiện trong hình 7. Các phản ứng tạo khí này xảy ra khi không còn PbSO4 trên các điện cực để nhường hoặc nhận electron. Do đó, chúng xảy ra khi pin được sạc đầy hoặc gần đầy. Lưu ý rằng các phản ứng sạc và xả (như trong hình 5, 6) liên quan đến thay đổi nồng độ chất điện ly của cell pin.
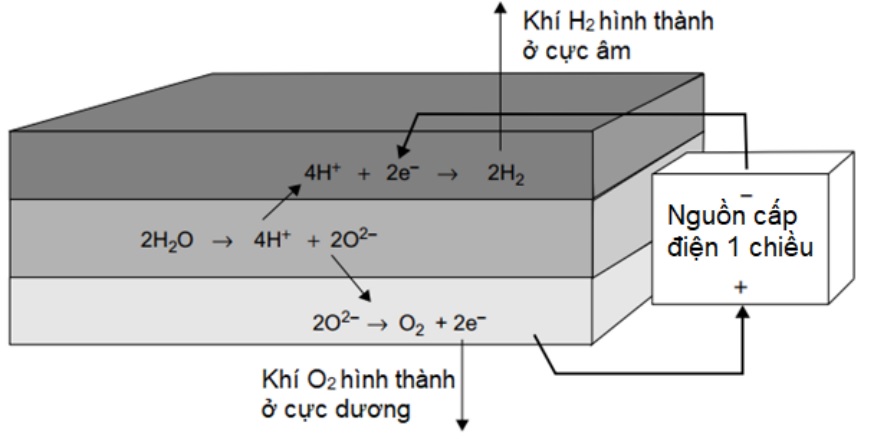
Hình 2. Phản ứng tạo khí ở các cực khi pin được sạc đầy
Sự thay đổi nồng độ của các chất phản ứng có nghĩa là có một sự thay đổi nhỏ trong điện áp tạo ra bởi cell pin khi nó phóng điện. Sự suy giảm điện áp này được minh họa trong hình 8. Đối với loại pin chì axit kín hiện đại, sự thay đổi là tuyến tính ở mức độ khá tốt. Lưu ý rằng điện áp này của pin thông thường không thể được sử dụng để chỉ thị trạng thái sạc của pin. Thông thường không thể đo điện áp hở mạch này khi pin đang được sử dụng và trong mọi trường hợp, nó cũng bị ảnh hưởng nhiều bởi nhiệt độ và do đó, một phép đo sự thay đổi của điện áp pin có thể bị ảnh hưởng mạnh bởi những yếu tố khác.
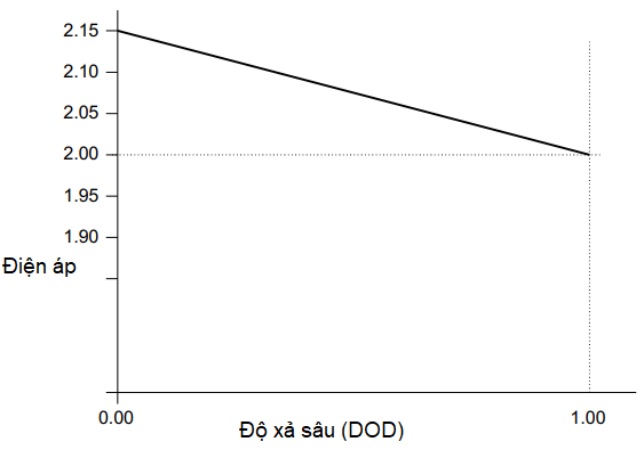
Hình 3. Sự thay đổi của điện áp mạch hở của cell pin chì axit loại kín
Một điểm đáng chú ý của việc sạc quá mức trong và hiện tượng tự pin tự xả là nước bị mất do biến thành H2 và O2. Trong các thiết kế pin cũ, khí này được thoát ra ngoài và mất đi nên chất điện phân phải được bổ sung nước định kỳ. Trong các loại pin kín hiện đại, điều này không cần thiết vì các khí bị giữ lại trong pin và được phép kết hợp lại (xảy ra một cách tự nhiên với tốc độ hợp lý) để tái hình thành ra nước. Tất nhiên mọi thứ đều phải có giới hạn để đảm bảo sao cho lượng khí tạo ra không quá nhanh.
Một vấn đề nữa trong việc sử dụng pin chì axit là các nhà sản xuất cung cấp ra rất nhiều loại sản phẩm với các kích cỡ khác nhau. Do đó khi lựa chọn pin chì axit phải lựa chọn đúng loại sao cho phù hợp với từng mục đích nhất định. Ví dụ như loại pin sử dụng cho các ô tô thông thường với mục đích như khởi động, chiếu sáng, đánh lửa ( pin SLI) sẽ không thể phù hợp cho xe điện. Hoặc loại pin sử dụng cho các hệ thống chiếu sáng sự cố hay báo động cũng không phù hợp cho xe điện. Chỉ có loại pin sử dụng cho mục đích truyền động hay loại có độ xả sâu được phát minh bởi Vincent và Scrosati (1998) mới phù hợp cho xe điện. Và đây là loại pin chì axit đắt nhất.
c. Tuổi thọ và bảo dưỡng pin
Như đã đề cập ở trên, pin chì axit có phản ứng tạo khí bên trong và dẫn đến làm giảm lượng dung dịch điện phân. Ở loại pin chì axit thông thường thì định kỳ cần phải bổ sung nước cất, còn ở loại pin chì axit hiện đại thì điều này là không cần thiết vì có được làm kín để ngăn việc các chất khí bay hơi. Ngoài ra còn có loại pin chì axit mà chất điện ly ở dạng keo tốt hơn dạng lỏng và nó cũng không cần phải bổ sung chất điện phân. Tuy nhiên, không phải chỉ cần làm kín pin là đủ mà bên trong pin cần phải có một van để xả khí khi đạt đến 1 áp suất nhất định. Và nếu điều này xảy ra thì sẽ có 1 lượng nước bị mất đi và ta không thể thay thế. Đây là một yêu cầu để đảm bảo tính an toàn cho pin. Và do đó loại pin chì axit này còn được gọi là pin chì axit kín có van điều chỉnh (valve regulated sealed lead acid - VRLA). Việc tạo ra chất khí như trên xảy ra khi pin bị sạc quá đầy hoặc sạc quá nhanh. Hay nói cách khác là ta sạc pin với điện áp quá cao. Vậy nên không nên để điều đó xảy ra nếu không pin sẽ bị hỏng. Như vậy đối với loại pin này thì ta không cần phả bảo dưỡng. Nhưng điều đó không có nghĩa là pin sẽ không bao giờ hỏng. Thậm chí ngay cả khi không có hiện tượng mất nước, pin chì axit cũng phải chịu rất nhiều tác động khiến nó giảm tuổi thọ. Một trong những hiện tượng phổ biến nhất đó là sunphat hóa. Hiện tượng này xảy ra khi pin bị để ở trạng thái phóng điện trong một thời gian dài. Khi đó chì sunphat sẽ hình thành trên các điện cực dưới dạng các tinh thể lớn. Và nó rất khó bị chuyển hóa ngược lại thành chì và chì đioxit khi sạc. Do đó trên bề mặt các điện cực sẽ hình thành một lớp cách điện. Bằng cách sạc chậm pin ta có thể phục hồi lại được một phần, song thường thì sẽ không khôi phục được.
Các vấn đề khác không thể được ngăn chặn cho dù sử dụng một cách cẩn thận. Bên trong các điện cực của pin diễn ra phản ứng ăn mòn nó làm tăng điện trở của các tiếp điểm giữa các tấm vật liệu hoạt động với các thanh nối các điện cực. Các tấm vật liệu hoạt động sẽ dần dần hình thành các tinh thể càng ngày càng lớn hơn trên bề mặt, điều này sẽ làm giảm diện tích bề mặt, dẫn đến làm giảm cả dung lượng của pin và làm chậm tốc độ phản ứng. Kết hợp giữa sự rung động từ bên ngoài và sự thay đổi kích thước liên tục của các tấm vật liệu hoạt động trong các chu kỳ sạc/xả sẽ dần dần loại bỏ chúng. Kết quả là tiếp xúc điện giữa chúng sẽ không còn tốt nữa, thậm chí một số tấm sẽ rơi ra và bị tách rời hoàn toàn. Tất cả những vấn đề này khiến tuổi thọ của pin axit chì bị giới hạn ở xung quanh 700 chu kỳ sạc xả, mặc dù điều này phụ thuộc nhiều vào độ sâu xả của các chu kỳ. Theo kinh nghiệm với các xe tải công nghiệp (xe nâng, vận chuyển hành lý tại nhà ga, v.v.) cho thấy rằng pin chì axit có thể tồn tại sau 1200 –1500 chu kỳ sạc xả, khoảng 7–8 năm. Đối với ô tô điện tham gia giao thông trên đường tuổi thọ khoảng 5 năm hoặc 700 chu kỳ. Tuổi thọ pin của các phương tiện giao thông đường bộ thường ngắn hơn các thiết bị sử dụng trong công nghiệp bởi chúng thường chịu tải lớn hơn và pin thường bị xả hết điện trong khoảng 2 giờ đồng hồ, trong khi đó ở các thiết bị công nghiệp thì thường xả trong khoảng 7-8 giờ.
d. Sạc pin chì axit
Sạc pin chì axit cũng như bất kỳ loại pin nào là một quy trình phức tạp. Nếu thực hiện không đúng cách sẽ nhanh chóng làm hỏng và giảm tuổi thọ của pin. Như đã đề cập ở trên, nếu pin được sạc ở hiệu điện thế quá cao sẽ dẫn đến mất nước của dung dịch điện phân. Có nhiều quan điểm khác nhau về cách tốt nhất để sạc pin chì axit và cách tốt nhất là theo lời khuyên của nhà sản xuất pin. Kỹ thuật phổ biến nhất được sử dụng cho pin axit chì được gọi là sạc nhiều bước. Trong phương pháp này, pin được sạc cho đến khi điện áp của cell được nâng lên đến điện áp định mức. Dòng điện sau đó được ngắt và điện áp của cell đã đạt đến định mức sẽ được nạp sang các cell khác và dòng điện sau đó được bật lại. Vấn đề là điện áp định mức của cell khác nhau không chỉ tùy thuộc vào loại pin mà còn tùy thuộc vào nhiệt độ. Tuy nhiên, pin axit chì được sử dụng rất rộng rãi trong nhiều lĩnh vực nên có rất nhiều nhà cung cấp các bộ sạc có chất lượng tốt. Một điểm quan trọng áp dụng cho tất cả các loại pin liên quan đến quá trình sạc đó là phải cân bằng pin nếu không pin sẽ bị hư hỏng nghiêm trọng.
e. Tổng quát về pin chì axit
Pin chì axit có tính thương mại cao và ngành công nghiệp chế tạo pin có lượng dự trữ tốt. Pin chì axit là loại pin có thể sạc lại có giá thành rẻ nhất trên mỗi Kwh và trong tương lai gần điều này vẫn không thay đổi. Tuy nhiên, chúng có năng lượng riêng thấp và khó có thể sử dụng trên những phương tiện có tầm hoạt động xa. Pin chì axit chắc chắn sẽ tiếp tục được sử dụng trong một thời gian đáng kể nữa cho các phương tiện giao thông có tầm hoạt động ngắn. Pin chì axit có dải hiệu suất công suất riêng rộng hơn nhiều các loại khác và do đó chúng đang được dùng nhiều trong xe lai, nơi chỉ cần lưu trữ một lượng năng lượng hạn chế, nhưng lại phải hoạt động một cách nhanh chóng khi cần.
2. Pin Nikel.
Một loạt các loại pin thương mại sử dụng Niken trong điện cực dương đã được phát triển kể từ công trình nghiên cứu của Edison vào cuối thế kỷ 19. Những loại pin này bao gồm sắt niken, niken kẽm, niken cadimi và pin niken hyđrua kim loại (NiMH). Hai trong số các loại pin này sẽ được nêu rõ dưới đây. Pin niken hyđrua kim loại cho thấy nhiều hứa hẹn nhất. Pin Niken kẽm có hiệu suất hợp lý nhưng nó có tuổi thọ rất hạn chế là 300 chu kỳ sâu xả sâu. Pin niken sắt cũng hiếm khi được sử dụng.
a. Pin Niken Cadimi (NiCad)
Pin niken cadmium được coi là một trong những đối thủ cạnh tranh chính của pin axit chì để sử dụng cho xe điện và loại pin này có năng lượng riêng gần gấp đôi pin axit chì.
Pin NiCad sử dụng niken oxyhydroxide cho điện cực dương và cadmium kim loại cho điện cực âm. Năng lượng điện thu được từ phản ứng sau.
Cd + 2Ni O OH + 2H2O « Cd(OH)2 + 2Ni(OH)2
Các phản ứng xảy ra trên các điện cực được mô tả trong hình 9, giúp làm rõ các electron được tạo ra từ đâu và pin hoạt động như thế nào. Có một điều trái ngược giữa pin này và pin chì axit đó là chất điện phân của nó lại đặc lại khi pin xả điện.
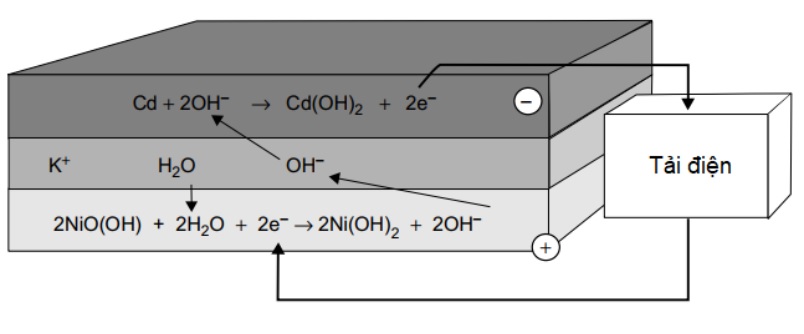
Hình 4. Các phản ứng xảy ra khi pin NiCad phóng điện
Pin NiCad đã được sử dụng rộng rãi trong nhiều thiết bị, bao gồm cả việc sử dụng trong xe điện. Pin NiCad có ưu điểm là công suất riêng cao, vòng đời dài (lên đến 2500 chu kỳ), phạm vi nhiệt độ hoạt động rộng từ − 400 C đến + 800 C, tự phóng điện thấp và lưu trữ lâu dài. Điều này là do pin là một hệ thống rất ổn định, với các phản ứng tương đương với quá trình tự phóng điện của pin chì axit chỉ diễn ra rất chậm. Pin NiCad có nhiều kích cỡ và hình dạng khác nhau, mặc dù không dễ dàng có được chúng với kích thước lớn hơn cần thiết cho xe điện, thị trường chính của chúng là các công cụ cầm tay và thiết bị điện tử. Chúng cũng rất mạnh mẽ cả về cơ học và điện năng và có thể được sạc lại trong vòng một giờ và lên đến 60% dung lượng trong 20 phút. Về mặt tiêu cực, điện áp hoạt động của mỗi cell chỉ khoảng 1,2 V, vì vậy cần 10 cell trong mỗi viên pin 12V danh nghĩa, so với 6 cell đối với pin chì axit. Điều này giải thích một phần giá thành của loại pin này cao hơn. Một vấn đề nữa là chi phí của cadmium gấp vài lần chì và điều này không có khả năng thay đổi. Cadmium cũng có hại cho môi trường và gây ung thư.
Bảng 2. Thông số của pin NiCad
|
Thông số |
Giá trị |
Ghi chú |
|
Năng lượng riêng |
40 - 55 Wh/kg |
Phụ thuộc vào dòng tải |
|
Mật độ năng lượng |
70 - 90 Wh/L |
Phụ thuộc vào dòng tải |
|
Công suất riêng |
» 125 W/kg |
|
|
Điện áp danh nghĩa của cell |
1.2 V |
|
|
Hiệu suất dung lượng |
Tốt |
|
|
Nội trở |
» 0.06 W |
trên mỗi cell có dung lượng 1Ah |
|
Tính thương mại |
Tốt với kích cỡ nhỏ, khó làm kích cỡ lớn |
|
|
Nhiệt độ làm việc |
- 400 ÷ + 800 C |
|
|
Tự xả điện |
0.5 % trên ngày |
rất thấp |
|
Chu kỳ sạc xả |
1200 |
đến khi còn khoảng 80 % dung lượng |
|
Thời gian sạc |
1 giờ |
sạc nhanh, 20 phút có thể sạc được 60% |
Chi phí của pin NiCad thường gấp 3 lần so với pin chì axit và nó được bù đắp phần nào đó bằng vòng đời dài hơn. Hiệu suất sạc của nó giảm nhanh chóng trên 350C nhưng điều này không ảnh hưởng đến việc sử dụng nó trong xe điện. Nó đã được sử dụng thành công trong những chiếc xe hơi như Peugeot 106, Citroen AX, Renault Clio và Ford Think.
Cũng như pin chì axit, pin NiCad cần được sạc đúng cách. Tuy nhiên, bởi vì các cell NiCad ít có xu hướng tự phóng điện hơn nên vấn đề có thể đơn giản hơn so với pin chì axit. Thông thường, pin được sạc với dòng điện không đổi cho đến khi điện áp cell của nó đạt đến giá trị định mức, lúc này dòng điện sẽ tắt. Tại thời điểm này, điện áp của cell giảm xuống mức thấp hơn điện áp định mức và dòng điện được bật trở lại. Quá trình này được tiếp tục cho đến khi pin được sạc lại.
Ngoài ra, pin có thể được sạc lại ở dòng điện không đổi, thấp hơn; đây là một hệ thống đơn giản hơn, nhưng mất nhiều thời gian hơn. Một tính năng thông minh của pin NiCad là cách nó đối phó với việc sạc quá mức. Cell pin được tạo ra để có lượng dư cadimi hydroxit trong điện cực âm. Điều này có nghĩa là điện cực dương sẽ luôn được sạc đầy trước. Nếu tiếp tục có dòng điện nạp thì sẽ dẫn đến việc tạo ra oxy ở điện cực dương thông qua phản ứng:
4OH− → 2H2O + O2 + 4e−
Kết quả là O2 tự do tạo thành khuếch tán đến điện cực âm ở đó nó tác dụng với Cadimi và H2O tạo ra Hyroxit Cadimi theo phản ứng:
O2 + 2Cd + 2H2O → 2Cd(OH)2
Cũng như phản ứng này, phản ứng sạc bình thường sẽ diễn ra ở điện cực này, sử dụng các điện cực được tạo ra bởi phản ứng:
2Cd(OH)2 + 4e− → 2Cd + 4OH−
Quan sát 2 phản ứng trên ta thấy tỉ lệ tạo ra Cadium Hydroxit bằng với tỉ lệ nó chuyển hóa thành Cadium. Do đó chúng ta có một hệ thống bền vững hoàn hảo, không sử dụng bất kỳ vật liệu nào từ pin. Tổng của 3 phản ứng trên là không ảnh hưởng gì đến pin. Do đó, tình trạng sạc quá mức này có thể tiếp tục vô thời hạn. Đối với hầu hết các loại pin NiCad, kích thước và thiết kế của chúng cho phép điều này tiếp tục mãi mãi ở tốc độ C/10, tức là ở 10A đối với pin 100 Ah. Tất nhiên việc quá tải dòng điện gây lãng phí năng lượng, nhưng nó không gây hại cho pin, và cần thiết trong một số cell trong khi sạc pin ở giai đoạn cuối để cân bằng tất cả các cell để được sạc đầy. Cần lưu ý rằng mặc dù nội trở của pin NiCad là rất thấp, nhưng nó không thấp như đối với pin chì axit. Điều này dẫn đến tính kinh tế về công suất riêng của nó thấp hơn. Công thức nội trở của pin NiCad là:
R = n.0,06/C3
Trong đó: n – là số cell trong viên pin
C3 – là dung lượng của pin khi phóng điện trong khoảng 3 giờ.
b. Pin Niken Hydrua kim loại (NiMH).
Pin NiMH đã được thương mại hóa vào thập kỷ cuối của thế kỷ 20. Nó có hiệu suất tương tự như pin NiCad, sự khác biệt chính là trong pin NiMH, điện cực âm sử dụng hydro, được hấp thụ trong một hydrua kim loại, giúp nó không chứa cadmium, một lợi thế đáng kể. Một tính năng độc đáo của loại pin này là điện cực âm hoạt động giống hệt như pin nhiên liệu. Phản ứng ở điện cực dương cũng giống như đối với pin NiCad; niken oxyhydroxit trở thành niken hydroxit trong quá trình phóng điện. Ở điện cực âm, H2 được giải phóng khỏi kim loại mà nó đã được gắn tạm thời, phản ứng tạo ra nước và các điện tử. Các phản ứng ở mỗi điện cực được thể hiện trên hình 10. Các kim loại được sử dụng để giữ hydro là hợp kim, mà công thức của chúng thường là độc quyền.
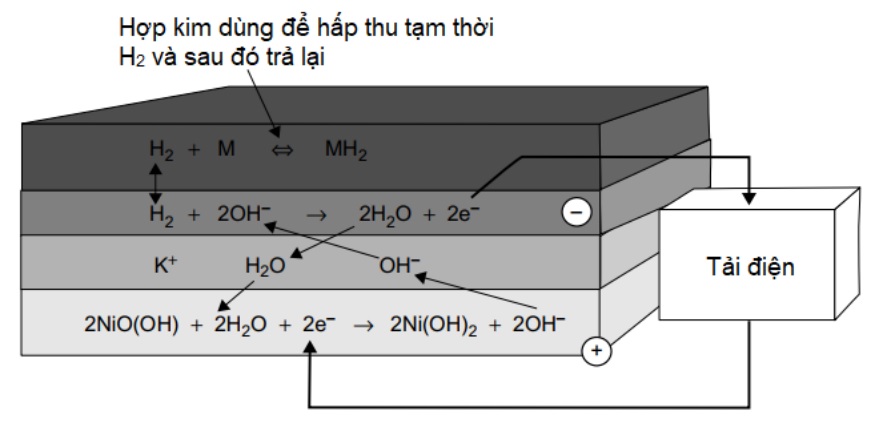
Hình 5. Các phản ứng xảy ra khi pin NiMH phóng điện.
Nguyên tắc hoạt động của chúng hoàn toàn giống như trong các hydro hydrua kim loại được sử dụng cùng với pin nhiên liệu. Nguyên tắc cơ bản là một phản ứng thuận nghịch, trong đó hydro được liên kết với kim loại, và sau đó được giải phóng dưới dạng hydro tự do khi cần thiết. Để điều này có thể diễn ra cell phải được làm kín, vì một xúc tác quan trọng trong quá trình hấp thụ/giải hấp là áp suất của khí hydro phải được duy trì ở một giá trị khá ổn định. Một điểm quan trọng nữa về vấn đề làm kín là các hợp kim hấp thụ hydro sẽ bị hỏng nếu không khí lọt vào cell. Đó là do chúng sẽ phản ứng với không khí và các phân tử khác sẽ chiếm giữ các vị trí được sử dụng để lưu trữ hydro.
Phản ứng hóa học tổng quát xảy ra trong pin NiMH như sau:
MH + NiOOH « M + Ni(OH)2
Xét về mật độ năng lượng và mật độ công suất, pin NiMH có phần tốt hơn so với pin NiCad. Pin NiMH có năng lượng riêng danh định khoảng 65Wh/kg và mật độ năng lượng danh định là 150 Wh/L và công suất riêng tối đa khoảng 200W/kg. Bảng 3 cung cấp thông các thông số của pin NiMH. Về hầu hết các khía cạnh, hiệu suất của nó tương tự hoặc tốt hơn một chút so với pin NiCad. Điện áp danh định của tế bào là 1,2 V. Một khía cạnh mà NiMH tốt hơn NiCad là có thể sạc pin nhanh hơn một chút do đó nó cần phải được làm mát.
Bảng 3. Thông số của pin NiMH
|
Thông số |
Giá trị |
Ghi chú |
|
Năng lượng riêng |
» 65 Wh/kg |
Phụ thuộc vào công suất |
|
Mật độ năng lượng |
» 150 Wh/L |
|
|
Công suất riêng |
» 200 W/kg |
|
|
Điện áp danh nghĩa của cell |
1.2 V |
|
|
Hiệu suất dung lượng |
Khá tốt |
|
|
Nội trở |
» 0.06 W |
mỗi cell có dung lượng 1Ah |
|
Tính thương mại |
Tốt với kích cỡ nhỏ, khó làm kích cỡ lớn |
|
|
Nhiệt độ làm việc |
Nhiệt độ môi trường |
|
|
Tự xả điện |
Thấp, khoảng 5% trên ngày |
|
|
Chu kỳ sạc xả |
1000 |
đến khi còn khoảng 80 % dung lượng |
|
Thời gian sạc |
1 giờ |
sạc nhanh, 20 phút có thể sạc được 60% |

Hình 6. Một khối pin NiMH với quạt làm mát tích hợp
Cùng với lượng nhiệt được tạo ra do nội trở của pin, phản ứng H2 liên kết với kim loại tiếp giáp với điện cực âm tỏa nhiệt khá mạnh. Ngoại trừ những pin cỡ nhỏ sử dụng trên các loại xe máy, hệ thống làm mát là một đặc tính quan trọng của hệ thống pin NiMH. Pin NiMH có khả năng lưu trữ năng lượng cao hơn một chút so với hệ thống NiCad và cũng đắt hơn một chút. Có một khía cạnh mà hiệu suất của nó kém hơn đáng kể so với pin NiCa đó là đặc tính tự xả của nó. Các phân tử H2 rất nhỏ, và chúng có thể dễ dàng khuếch tán qua chất điện phân đến điện cực dương, nơi nó sẽ phản ứng:
H2 + Ni O OH → Ni(OH)2
Kết quả là H2 bị mất từ cực âm và niken hydroxit được hình thành ở cực dương. Việc này khiến pin tự xả khá nhanh. Một đặc điểm độc đáo của pin NiMH là thành phần của chất điện phân không thay đổi trong quá trình sạc hoặc phóng điện; nước và ion OH− được tạo ra và sử dụng với tỷ lệ chính xác. Kết quả là điện trở bên trong và điện áp mạch hở của cell không thay đổi nhiều trong quá trình phóng điện so với pin chì axit hoặc pin NiCad.
Chế độ sạc của pin NiMH tương tự như của pin NiCad, dòng điện được bật và tắt để giữ điện áp cell ở giữa giới hạn trên và giới hạn dưới. Giống như pin NiCad, pin NiMH có thể được sạc trong vòng 1 giờ. Hầu hết các cell có thể đối phó với dòng điện quá tải khoảng 0,1.C như cell pin NiCad. Việc sạc quá mức là cần thiết trong pin để đảm bảo mọi tế bào đều được sạc đầy. Pin NiMH là một trong những loại pin tiên tiến và đã được sử dụng trên nhiều loại xe, bao gồm cả Toyota Prius - một dòng xe hybrid chạy điện thành công nhất cho đến nay.
3. Pin Lithium
Kể từ cuối những năm 1980, các loại pin lithium có thể sạc lại đã xuất hiện trên thị trường. Chúng cung cấp mật độ năng lượng tăng lên đáng kể so với các loại pin có thể sạc lại khác, mặc dù có chi phí cao hơn rất nhiều. Và sau đó nó đã được sử dụng phổ biến trên các thiết bị như máy tính xách tay, điện thoại di động thay thế cho các loại pin NiCad hoặc NiHM dù những loại pin này có chi phí thấp hơn.
a. Pin lithium polyme
Pin lithium polyme sử dụng kim loại lithium cho điện cực âm và một oxit kim loại cho cực dương. Trong phản ứng hóa học của pin, liti kết hợp với oxit kim loại để tạo thành oxit kim loại liti và giải phóng năng lượng. Khi mà pin được sạc lại thì phản ứng hóa học diễn ra ngược lại. Do đó, liti vừa là chất phản ứng vừa là ion di động di chuyển qua chất điện phân. Phản ứng hóa học tổng thể là:
xLi + MyOz « LixMyOz
Điện cực âm liti rắn là nguyên nhân gây ra các vấn đề với loại tế bào này; có những vấn đề về an toàn và đôi khi giảm hiệu suất. Vì vậy, chúng đã được thay thế phần lớn bằng pin lithium ion.
b. Pin lithium ion
Pin Lithium-ion hoạt động dựa trên phản ứng thêm vào ở cả điện cực âm và điện cực dương, nơi các ion liti hoạt động như hệ thống vận chuyển điện tích để lưu trữ năng lượng. Năm 1991, Sony trở thành hãng đầu tiên sản xuất và bán pin lithium-ion. Ý tưởng về tính thuận nghịch trong chuyển động của ion liti giữa các điện cực trong pin lần đầu tiên được phát triển bởi Armand, ông đã sử dụng các vật liệu xen kẽ khác nhau cho hai điện cực. Nó cho phép các ion liti chảy ngược trở lại và chuyển tiếp giữa hai điện cực. Phòng thí nghiệm Goodenough phát hiện ra tính thuận nghịch của cấu trúc tinh thể NaFeO2 trong sự tập trung của các ion liti ở điện thế tương đối cao. Các kim loại bao gồm magiê, nhôm, sắt, v.v. với hỗn hợp niken và coban được phát hiện sau đó có khả năng tương tự và Sony đã sử dụng oxit coban liti (LiCoO2) trở thành vật liệu hoạt động tích cực cho pin lithium-ion của hãng. Lithi coban oxit (LiCoO2) là chất đầu tiên và phổ biến nhất của cực âm dạng oxit kim loại chuyển tiếp phân lớp. Nó rất thích hợp để làm vật liệu cho cực âm vì nó có công suất riêng lý thuyết cao, dung lượng, điện áp xả và hiệu suất chu kỳ tốt. Trong khi đó, các loại cực âm của pin lithium-ion bao gồm than chì hoặc liti titanate (Li4Ti5O12) và một số vật liệu khác vẫn còn đang trong quá trình phát triển, cụ thể là kim loại liti và hợp kim Li-Si. Các chất điện phân được sử dụng thường được tạo ra để cho phép chuyển động của các ion giữa các điện cực với một hỗn hợp dung môi hữu cơ và muối liti. Bên cạnh đó, một màng ngăn cách hoặc bộ phân tách được sử dụng để tách cả hai điện cực ra khỏi nhau, cho phép các ion Li đi qua trong khi loại bỏ khả năng xảy ra ngắn mạch bên trong. Hình 12 cho thấy sơ đồ cấu tạo của một cell pin của pin lithium-ion.
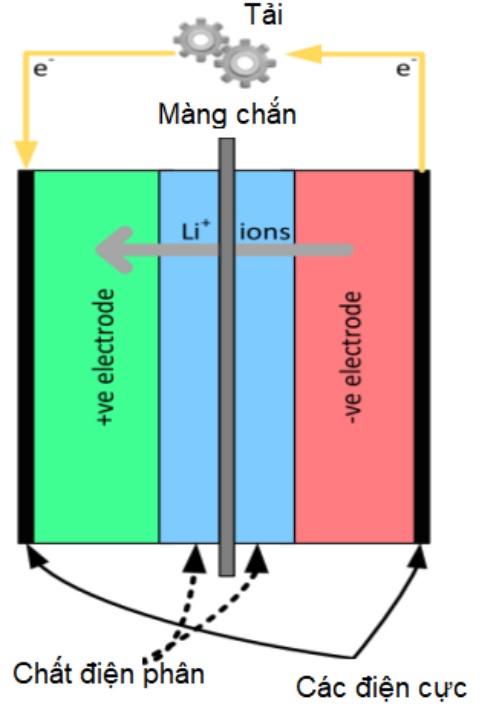
Hình 7. Cấu tạo 1 cell pin Li – ion.
âm.
Dựa vào hình 12 ta thấy màng chắn ngăn sự tiếp xúc trực tiếp giữa hai điện cực. Các electron di chuyển từ điện cực âm qua tải sang cực dương. Đồng thời, các ion liti (Li +) di chuyển từ điện cực âm sang điện cực dương dung dịch điện phân để có thể duy trì tính âm cho cực âm. Hiện tại, có rất nhiều lựa chọn về vật liệu để làm điện cực dương, điện cực âm và chất điện phân trong pin lithium-ion. Chất điện phân phải cung cấp khả năng vận chuyển ion lithium cao nhất có thể trong các điều kiện sử dụng. Pin phải hoạt động trong môi trường thông thường, có khả năng mở rộng thêm, ví dụ: từ -300 C đối với xe đã đỗ trong thời tiết quá lạnh đến +600 C đối với pin bị nóng lên do hậu quả của sự kết hợp giữa các điều kiện môi trường và nhiệt sinh ra khi nạp điện. Tương tự như vậy, màng chắn phải cung cấp khả năng dẫn ion lithium cao nhất có thể trong cùng điều kiện hoạt động và phải cung cấp khả năng ngắt nhiệt nhanh nếu xảy ra quá nhiệt đáng kể để ngăn chặn quá trình thoát nhiệt. Phải tồn tại sự kết hợp phù hợp giữa vật liệu làm điện cực âm và dương để tạo ra pin dung lượng cao đồng thời có chi phí hợp lý. Hình 16 dưới đây tóm tắt về vật liệu làm điện cực pin và điện thế nửa cell điện hóa của chúng so với tham chiếu Li / Li +. Điện áp cuối cùng của cell là sự chênh lệch giữa cặp vật liệu làm điện cực đã chọn và được sửa đổi thêm do tổn thất, chẳng hạn như quá áp cần thiết để đạt được dòng điện, hoặc tổn thất IR do vận chuyển ion Li + kém qua chất điện phân. Ví dụ: nếu LiFePO4 được chọn làm nửa ô dương và Li4Ti5O12 làm nửa ô âm, thì điện áp mạch hở danh nghĩa sẽ là VOC = (V+) – (V−) = 3,45 – 1,5 = 1,95 V, trong đó (V +) đại diện cho điện thế nửa ô điện cực dương và (V -) là của điện cực.
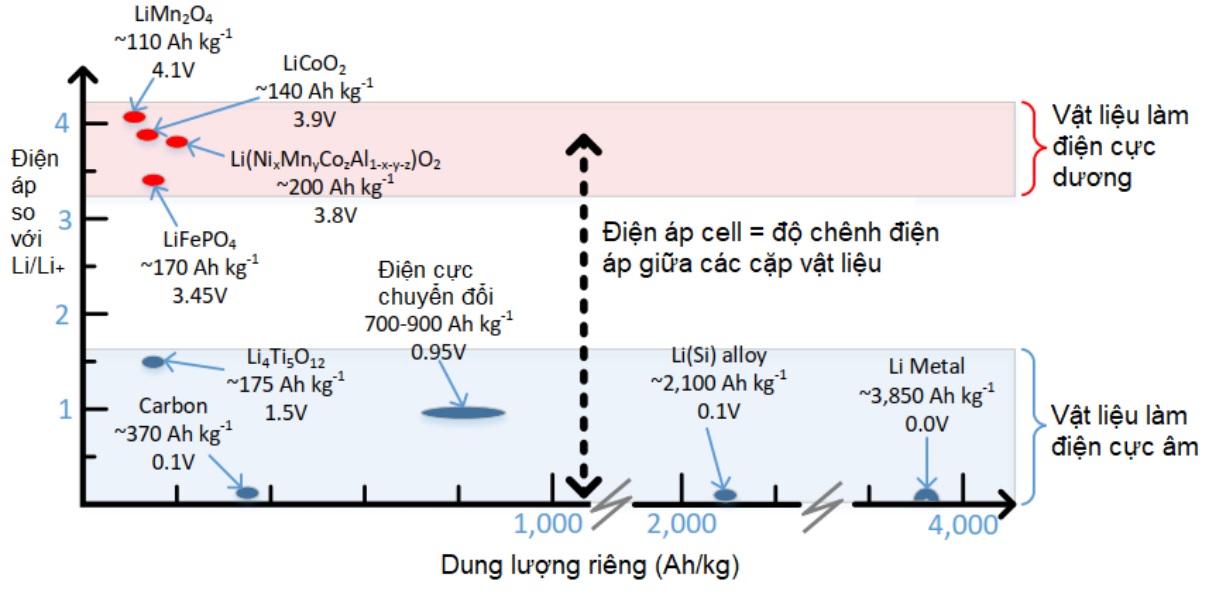
Hình 8. Vật liệu cho các điện cực của pin Li-ion ở hiện tại và trong tương lai
Tương tự như vậy, dung lượng của cell được quy định bởi dung lượng cụ thể của từng vật liệu điện cực có trong tế bào và thực tế là các dung lượng bằng nhau có mặt cho các điện cực dương và âm. Ví dụ, sử dụng các dung lượng được trình bày trong hình 13 để xây dựng các cặp vật liệu như chọn LiFePO4 (170 Ah/kg) được ghép nối với Li4Ti5O12 (175 Ah/kg), giả sử một tỷ lệ lý tưởng của vật liệu điện cực âm và dương theo cách tương xứng với dung lượng lý thuyết của chúng, tỷ lệ LiFePO4 lý tưởng hóa: Li4Ti5O12 = 170 Ah/kg : 175 Ah/kg = 0,97, có nghĩa là một pin lý tưởng có dung lượng 170 Ah sẽ chứa 1 kg LiFePO4 và 0,97 kg Li4Ti5O12. Do khối lượng của cả hai điện cực cộng lại chỉ chiếm khoảng 15% tổng khối lượng của các thành phần còn lại của một cell pin, nên cell pin có dung lượng riêng là: ((170 Ah) / (1 kg + 0,97 kg)) / 1,15 = 75 Ah/kg. Nếu vẫn sử dụng điện cực dương đó đem ghép nối với một điện cực âm cacbon (370 Ah/kg, dẫn đến tỷ lệ khối lượng điện cực là 170 Ah/kg: 370 Ah/kg = 0,46), và cùng mức khối lượng cho phép của điện cực là 15% sẽ dẫn đến một pin có dung lượng riêng khoảng 101 Ah/ kg. Năng lượng riêng của pin sau đó sẽ thu được bằng cách nhân dung lượng thu được này với điện áp tế bào dự kiến cho sự kết hợp của cặp vật liệu làm điện cực này. Pin Lithium ion hiệu suất dung lượng cao nhất trong các loại pin có thể sạc lại (hơn 99%). Hiệu suất dung lượng của pin Li-ion được cải thiện khi thực hiện các chu kỳ xả sạc. Để chứng minh điều này, các pin Li-ion của Panasonic, E-one Moli, Sony, LG và Samsung ở định dạng cell 18.650 đã thực hiện các chu kỳ xả sạc. Một số cell bắt đầu với hiệu suất dung lượng là 99,1% và được cải thiện lên 99,5% sau 15 chu kỳ. Một số bắt đầu ở mức 99,5% và đạt 99,9% sau 30 chu kỳ. Tính nhất quán cao trong các bài kiểm tra lặp lại, phản ánh Li-ion là một hệ thống pin rất ổn định. Cấu trúc vật lý của các cell pin Li-ion: Các cell pin Li-ion riêng lẻ có thể được thiết kế với nhiều hình dáng, kích thước khác nhau, xem trong bảng 4. Tính linh hoạt này giúp mở rộng việc sử dụng pin Li-ion vì chúng có thể được thiết kế dựa trên nhiều dạng khác nhau cho từng nhu cầu cụ thể.
Bảng 4. Cấu trúc vật lý của các cell pin Li-ion và các thông số liên quan.
|
Hình dáng |
Hình trụ |
Hình lăng trụ |
Hình túi nhỏ |
|
Bố trí điện cực |
quấn lại |
quấn lại |
xếp lớp |
|
Sức bền cơ học |
++ |
+ |
- |
|
Quản lý nhiệt |
- |
+ |
+ |
|
Năng lượng riêng |
+ |
+ |
++ |
|
Mật độ năng lượng |
+ |
++ |
+ |
Bảng 5. Thông số của pin Li-ion
|
Thông số |
Giá trị |
Ghi chú |
|
Năng lượng riêng |
150-200 Wh/kg |
|
|
Mật độ năng lượng |
250 - 400 Wh/L |
|
|
Công suất riêng |
260 W/kg |
|
|
Điện áp danh nghĩa của cell |
3.5 V |
|
|
Hiệu suất dung lượng |
Rất tốt |
|
|
Nội trở |
0.32W |
|
|
Tính thương mại |
Nhiều nhà cung cấp |
|
|
Nhiệt độ làm việc |
nhiệt độ môi trường |
|
|
Tự xả điện |
rất thấp, 10%/tháng |
|
|
Chu kỳ sạc xả |
2000 |
|
|
Thời gian sạc |
2-3h |
phụ thuộc chế độ sạc |
Nguồn tin: admin
Những tin mới hơn
Những tin cũ hơn
- Chính sách bảo đảm chất lượng giai đoạn 2025 –...
- Triết lý giáo dục, sứ mạng, tầm nhìn và giá trị...
- Khoa Ô tô – địa chỉ đào tạo uy tín, chất lượng
- Triết lý giáo dục Trường Đại học Sao Đỏ
- Tham gia vòng chung kết cuộc thi sáng tạo Robocon...
- 068/QĐ-ĐHSĐ - QĐ vv hỗ trợ chi phí học tập cho SV...
- Kế hoạch Tổ chức các hoạt động chào mừng ngày Nhà...
- Tuyển sinh viên học lớp Kỹ thuật viên Toyota khóa...
- Đội OTOSDU01 và đội SAODOHD2 trường đại học Sao Đỏ...
- Bộ Giáo dục và đào tạo công bố quy chế tuyển sinh...
- Đang truy cập41
- Hôm nay
- Tháng hiện tại
- Tổng lượt truy cập


